Se è un decimale probabilmente stai guardando la massa atomica. 
Potrebbe esserci uno spazio vuoto dopo gli elementi 56 (bario) e 88 (radio). In realtà non c`è uno spazio; gli elementi con i numeri atomici che vi appartengono sono in due righe sotto il resto del sistema. L`unico motivo per cui sono separati in questo modo è rendere la tavola periodica meno ampia. 
Per dirla in altro modo, qualsiasi atomo con otto protoni è un atomo di ossigeno. Due atomi di ossigeno possono avere un diverso numero di neutroni o (se uno è uno ione) un diverso numero di elettroni, ma entrambi avranno sempre otto protoni. 

In pratica, la massa atomica è solitamente già data per problemi di chimica che riguardano un solo atomo. Comprendere questo concetto per non sorprendersi se differisce dal peso atomico. 
Funziona perché neutroni e protoni sono entrambi vicini a 1 AMU e gli elettroni sono vicini a 0 AMU. Per il peso atomico si usano misure precise per ottenere il numero decimale, ma a noi interessano solo gli interi che ci dicono il numero di protoni e neutroni. Ricorda che se usi il peso atomico ottieni una media per un campione tipico. Un campione di bromo ha un numero di massa di circa 80, ma a quanto pare, un singolo atomo di bromo ha quasi sempre un numero di massa di 79 o 81. 
Un singolo atomo di elio (He) ha un numero di massa di 4 e un numero atomico di 2. Pertanto deve essere 4 - 2 = 2 neutroni avere. Un campione di argento (Ag) ha un numero di massa di circa 108 (secondo la tavola periodica) e un numero atomico di 47. In media, ogni atomo d`argento nel campione ha 108 - 47 = 61 neutroni. 
Gli isotopi non hanno un numero atomico diverso. Ogni isotopo di un elemento ha lo stesso numero di protoni.
Determina il numero atomico di un elemento
Contenuto
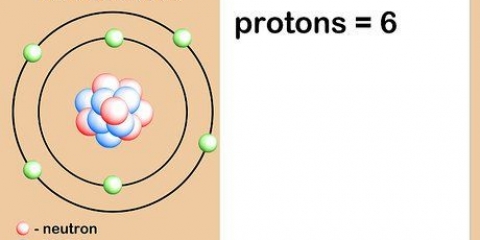
Il numero atomico di un elemento è il numero di protoni nel nucleo di un singolo atomo di quell`elemento. Il numero atomico di un elemento o isotopo non cambia, quindi puoi utilizzare il numero atomico per calcolare altre caratteristiche di un elemento o isotopo, come il numero di neutroni.
Passi
Parte 1 di 2: Trovare il numero atomico

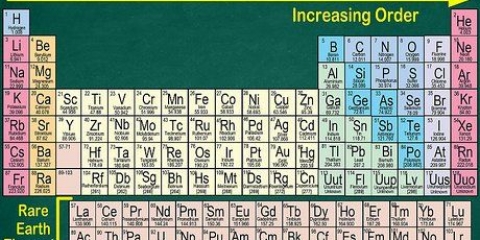
1. Trova una copia della tavola periodica. Puoi trovarne uno qui se non ne hai uno a portata di mano. Ogni elemento ha un numero atomico diverso, quindi non ci sono metodi facili e veloci da applicare. Dovrai trovare una copia della tavola periodica o una bisogna imparare a memoria.
- La maggior parte dei libri di chimica ha una tavola periodica stampata sulla copertina interna.

2. Trova l`elemento che stai studiando. La maggior parte delle tavole periodiche contiene i nomi completi dei vari elementi, nonché i loro simboli chimici (come Hg per il mercurio). Se hai difficoltà a trovare l`elemento, dovresti cercare online `simbolo chimico` seguito dal nome dell`elemento.

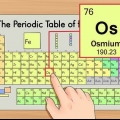
3. Trova il numero atomico. Il numero atomico è solitamente nell`angolo in alto a sinistra oa destra della casella in cui si trova l`elemento, ma può anche essere da qualche altra parte nella casella. Il numero atomico è sempre un numero intero.

4. Verifica rispetto agli elementi vicini. La tavola periodica è organizzata per numero atomico. Se il numero atomico del tuo elemento è "33", l`elemento a sinistra dovrebbe essere "32" e l`elemento a destra dovrebbe essere "34". Se questo ordine è corretto hai sicuramente trovato il numero atomico.

5. Capire qual è il numero atomico. C`è una semplice definizione per il numero atomico di un elemento: il numero di protoni in un atomo di quell`elemento. Questa è la definizione di base di un elemento. Il numero di protoni determina la carica elettrica totale del nucleo, che determina quanti elettroni può avere un atomo. Poiché gli elettroni sono responsabili di quasi tutte le reazioni chimiche, il numero atomico determina indirettamente quasi tutte le proprietà fisiche e chimiche di un elemento.
Parte 2 di 2: Trovare informazioni correlate

1. Trovare il peso atomico. Il peso atomico viene solitamente stampato sotto il nome dell`elemento in questione nella tavola periodica e viene solitamente calcolato con due o tre cifre decimali. Questa è la massa media di un atomo dell`elemento, adattata per corrispondere a ciò che probabilmente incontri in natura. Questo numero è in "unità di massa atomica" (AMU (dall`inglese "unità di massa atomica")).
- Alcuni scienziati usano il termine "massa atomica relativa" invece di "peso atomico".

2. Capire qual è la massa atomica. La massa atomica è un concetto molto simile a quello di peso atomico. L`unica differenza è che stai parlando di un atomo specifico invece della media di un campione. Un grammo di ferro contiene molti atomi con masse leggermente diverse tra loro, quindi cerchi il "peso relativo" per trovare la media. Se sei interessato solo a uno specifico atomo di ferro, la media non ti interessa: sei interessato solo alla massa esatta di quel particolare atomo.

3. Arrotonda al numero di massa. Il numero di massa è il numero totale di protoni più neutroni in un atomo di un elemento. Puoi trovare questo numero facilmente: prendi il peso atomico dato nella tavola periodica e arrotonda al numero intero più vicino.

4. Calcola il numero di neutroni. Ora sai che il numero atomico = numero di protoni e che il numero di massa = numero di protoni + numero di neutroni. Per scoprire quanti neutroni ci sono in un elemento, devi sottrarre il numero atomico dal numero di massa. Ecco alcuni esempi:

5. Capire cosa sono gli isotopi. Un isotopo è una forma specifica di un elemento con un certo numero di neutroni. Quando una domanda di chimica parla di "boro-10" o "B", sta parlando dell`elemento boro con un numero di massa di 10. Usa questo numero di massa invece del valore del boro "tipico".
Consigli
- Alcuni elementi più pesanti hanno pesi atomici racchiusi tra parentesi o parentesi. Ciò significa che il peso atomico è la massa esatta dell`isotopo più stabile, piuttosto che la media di più isotopi. (Ciò non ha effetto sul numero atomico dell`elemento.)
Articoli sull'argomento "Determina il numero atomico di un elemento"
Condividi sui social network:
Simile
Popolare