Poiché gli atomi sono straordinariamente piccoli, gli scienziati di solito lavorano con atomi in quantità maggiori chiamate mulino. Una mole è la quantità di una sostanza con tanti atomi quanti sarebbero in 12 grammi di isotopo carbonio-12. Questo numero è di circa 600 trilioni (6 volte 10 alla 23a potenza) di atomi ed è noto come costante di Avogadro, dal nome dello scienziato che l`ha definito. 


Un libro di riferimento fornirà rapporti basati su tutte le quantità note di isotopi di un elemento, mentre lo spettrometro di massa fornirà i rapporti per il campione in prova. 
Nell`esempio sopra: 12 x 0,99 = 11,88 per il carbonio-12 e 13 x 0,01 = 0,13 per il carbonio-13. La massa atomica relativa è 11,88 + 0,13 = 12,01. (A causa dei rapporti degli isotopi, le masse atomiche relative sulle tavole periodiche sono raramente numeri interi.)
Calcola la massa atomica
Contenuto
La massa atomica è la massa di un isotopo specifico di un dato atomo, ma è anche usata in modo improprio per descrivere il peso medio di un campione di diversi isotopi dello stesso elemento, che in realtà è chiamato massa atomica relativa o peso atomico. Qualunque sia il valore che stai cercando, ti mostreremo i passaggi per calcolare la massa atomica e la massa atomica relativa.
Passi
Metodo 1 di 2: Calcola la massa atomica

1. Trova il numero atomico dell`elemento o dell`isotopo. Il numero atomico è il numero di protoni in un elemento e non cambia mai. Ad esempio: tutti gli atomi di idrogeno, solo e solo atomi di idrogeno, hanno un protone. Il carbonio ha il numero atomico 6 perché il suo nucleo ha sei protoni mentre l`ossigeno ha il numero atomico 8 perché il suo nucleo ha otto protoni.

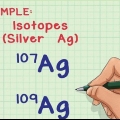
2. Determina il numero di neutroni nel nucleo. Il numero di neutroni può variare all`interno di un atomo - sebbene siano lo stesso elemento, ci sono diversi isotopi di quell`elemento. Due isotopi dello stesso elemento avranno lo stesso numero di protoni, ma un diverso numero di neutroni.

3. Ignora il numero di elettroni in orbita attorno al nucleo. La massa di elettroni di un atomo è trascurabile rispetto ai protoni e ai neutroni nel nucleo.

4. Somma il numero di protoni e neutroni. Questa è la massa atomica di quell`atomo.
Metodo 2 di 2: Calcola la massa atomica relativa (peso atomico)

1. Determinare il numero di isotopi nel campione. Quali isotopi sono nel campione possono essere determinati utilizzando uno spettrometro di massa.

2. Determinare l`abbondanza relativa di ciascun isotopo nel campione. Queste informazioni possono essere ottenute mediante spettrometria di massa o da un libro di riferimento.

3. Moltiplica la massa atomica di ciascun isotopo per il suo rapporto nel campione. In un campione contenente carbonio-12 e carbonio-13, se il 99 percento del campione è carbonio-12, moltiplicare 12 per 0,99 e 13 per 0,01.

4. Somma i risultati. Il totale è la massa atomica relativa, o peso atomico, del campione.
Consigli
- Alcuni isotopi sono meno stabili di altri e si scompongono in elementi con meno protoni e neutroni nei loro nuclei mentre respingono parti di se stessi. Questi isotopi sono chiamati radioattivi.
Necessità
- Spettrometro di massa
- Libro di consultazione chimica
- Calcolatrice
Articoli sull'argomento "Calcola la massa atomica"
Condividi sui social network:
Popolare