Se conosci i dettagli del tuo elemento, ad esempio in quale gruppo o periodo si trova, è più facile trovarlo. Se non sai nulla dell`elemento stesso, cerca nella tabella il simbolo corrispondente finché non lo trovi. 
Ad esempio, il numero atomico del boro (B) è 5, il che significa che contiene 5 protoni e 5 elettroni. 

Poiché un elettrone ha una carica negativa, lo ione diventerà più negativo se aggiungi elettroni extra. Quando rimuovi gli elettroni, lo ione diventa più positivo. Ad esempio, N ha una carica di -3, mentre Ca ha una carica di +2. 
Ad esempio, Ca ha una carica di +2 e quindi 2 elettroni in meno rispetto a un atomo di calcio neutro. Il numero atomico del calcio è 20, quindi questo ione ha 18 elettroni. 
Ad esempio, N ha una carica di -3, il che significa che ha 3 elettroni in più rispetto a un atomo di azoto neutro. Il numero atomico dell`azoto è 7, quindi questo ione ha 10 elettroni.
Determinazione del numero di elettroni in un elemento
Contenuto
Un elettrone è una particella carica negativamente e fa parte di un atomo. Tutti gli elementi di base sono costituiti da elettroni, protoni e neutroni. Un concetto fondamentale in chimica è la capacità di determinare quanti elettroni contiene un atomo. Questo può essere facilmente determinato utilizzando la tavola periodica degli elementi. Altri concetti importanti sono il numero di neutroni e elettroni di valenza (il numero di elettroni nel guscio più esterno di un atomo) in un elemento.
Passi
Metodo 1 di 2: Determinazione del numero di elettroni in un atomo neutro

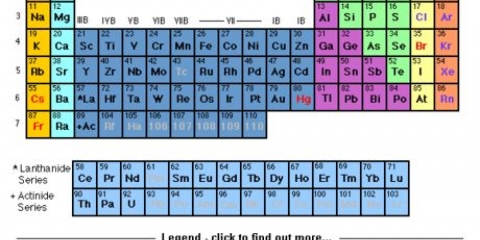
1. Avere una tavola periodica degli elementi. Questa è una tabella con codice colore in cui tutti gli elementi conosciuti sono ordinati in base alla struttura atomica. Ogni elemento ha un`abbreviazione di 1, 2 o 3 lettere ed è elencato, oltre alla massa atomica e al numero atomico.
- Nella maggior parte dei libri di testo di chimica troverai una tavola periodica (oppure cerca online).

2. Trova l`elemento in questione nella tavola periodica. Gli elementi sono ordinati per numero atomico e divisi in tre gruppi principali: metalli, non metalli e metalloidi (semimetalli). Inoltre, sono ulteriormente raggruppati in famiglie, tra cui i metalli alcalini, gli alogeni ei gas nobili. Ogni colonna della tabella è chiamata gruppo e ogni riga punto.

3. Determina il numero atomico di un elemento. Il numero atomico si trova nell`angolo in alto a sinistra, sopra il simbolo dell`elemento nella casella. Il numero atomico è il numero di protoni in un elemento. I protoni sono le particelle in un elemento con una carica positiva. Poiché gli elettroni hanno una carica negativa, un elemento neutro ha lo stesso numero di protoni degli elettroni.
Metodo 2 di 2: Determinazione del numero di elettroni in ioni caricati positivamente/negativamente

1. Determina il numero atomico di un elemento. Il numero atomico è nell`angolo in alto a sinistra; sopra il simbolo dell`elemento nella casella. Il numero atomico è il numero di protoni in un elemento. I protoni sono le particelle in un elemento con una carica positiva. Poiché gli elettroni hanno una carica negativa, un elemento neutro ha lo stesso numero di protoni degli elettroni.
- Ad esempio, il numero atomico del boro (B) è 5, il che significa che contiene 5 protoni e 5 elettroni.

2. Determina la carica dello ione. L`aggiunta o la rimozione di elettroni da un atomo non cambierà la sua identità, ma la sua carica cambierà. In questi casi ora è diventato uno ione, come K, Ca o N. Di solito la carica viene mostrata in apice a destra dell`abbreviazione dell`atomo.

3. Sottrarre la carica dal numero atomico se lo ione è positivo. Se la carica è positiva, lo ione ha perso elettroni. Per determinare quanti elettroni sono rimasti, sottrarre la carica dal numero atomico. In questo caso ci sono più protoni che elettroni.

4. Somma la carica al numero atomico se la carica è negativa. Se la carica è negativa, lo ione ha guadagnato elettroni. Per determinare quanti elettroni ci sono in totale, aggiungi la carica al numero atomico. In questo caso ci sono meno protoni che elettroni.
Articoli sull'argomento "Determinazione del numero di elettroni in un elemento"
Condividi sui social network:
Simile
Popolare