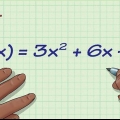Zero significa che la concentrazione di quel reagente non influisce sulla velocità di reazione. Uno significa che aumentando la concentrazione di questo reagente aumenterà la velocità di reazione in modo lineare (raddoppiando il reagente raddoppia la velocità del reagente). Due significa che la velocità della reazione aumenterà del quadrato della concentrazione aumentata (il raddoppio del reagente aumenterà la velocità di quattro volte). I reattori zero spesso non sono elencati nell`equazione della velocità perché qualsiasi numero elevato a potenza zero è uguale a uno. 
Ad esempio, supponiamo che il primo reagente sia del primo ordine (ha un esponente di 1) e il reagente due sia del primo ordine (anche esponente 1), quindi la reazione generale è di secondo ordine. 







Determinazione dell'ordine di una reazione
Contenuto
Sapere come diverse concentrazioni di sostanze chimiche influiscono sulla velocità di una reazione è essenziale per molti processi chimici. Il termine "ordine di reazione" (o ordine di reazione) si riferisce a come la concentrazione di uno o più reagenti (sostanze chimiche) influisce sulla velocità della reazione. L`ordine finale di una reazione è la somma dell`ordine di tutti i reagenti presenti. Anche se guardare un`equazione di equilibrio non ti aiuterà a determinare l`ordine della reazione, puoi ottenere queste informazioni guardando l`equazione di velocità o rappresentando graficamente la reazione in questione.
Passi
Metodo 1 di 3: Analisi dell`equazione della velocità

1. Determina l`equazione della velocità della reazione. L`equazione della velocità può aiutarti a determinare l`ordine della reazione. Questa equazione mostra l`aumento o la diminuzione di una data sostanza nel tempo. Altre equazioni relative alla reazione chimica non ti aiuteranno a determinare l`ordine della reazione.

2. Controllare l`ordine di ciascun reagente. Ogni reagente nell`equazione della velocità avrà un esponente di 0, 1 o 2 (sopra 2 è molto raro). Quell`esponente indica l`ordine di quel reagente. Osserviamo ogni esponente:

3. Aggiungi l`ordine per tutti i reagenti insieme. L`ordine totale di una reazione è la somma dell`ordine di tutti i reagenti. Somma gli esponenti di ciascun reagente per determinare l`ordine generale della reazione. Questo numero è solitamente minore o uguale a due.
Metodo 2 di 3: Visualizza i punti dati come un grafico

1. Trova le variabili che compongono un grafico lineare della reazione. Un grafico lineare si riferisce a un grafico che ha una velocità di variazione costante. In altre parole, la variabile dipendente cambierà tanto nel primo secondo quanto nella seconda, terza e così via. Un grafico lineare appare come una linea retta.

2. Tracciare la concentrazione del reagente rispetto al tempo. Questo indica quanto reagente è rimasto in un dato punto durante la reazione. Se questo grafico è lineare, significa che la concentrazione del reagente non influisce sulla velocità con cui procede la reazione. In questo caso il reagente è di ordine zero.

3. Dare il logaritmo naturale della concentrazione del reagente rispetto al tempo. Se il logaritmo naturale del reagente risulta in un grafico lineare, il reagente è uno del primo ordine. Ciò significa che la concentrazione del reagente influisce sulla velocità di reazione. Se il grafico non è lineare, è necessario testare il grafico per una reazione del secondo ordine.

4. Tracciare [1/concentrazione di reagente] rispetto al tempo. Un grafico lineare di [1/concentrazione di reagente] indica una reazione del secondo ordine. Ciò significa che la velocità della reazione aumenterà del quadrato di qualsiasi aumento del reagente. Se questo grafico non è lineare, dovresti provare a rappresentare graficamente le reazioni zero e del primo ordine.

5. Trova la somma dell`ordine di tutti i reagenti. Una volta trovato un grafico lineare per ciascun reagente, conosci anche l`ordine di ciascun reagente. Consente di calcolare l`ordine risultante della reazione. Somma tutte le sequenze reattive. Questo è quindi l`ordine di reazione dell`intera reazione.
Metodo 3 di 3: risoluzione di casi di studio

1. Determinare l`ordine di una reazione quando raddoppiando uno dei reagenti si ottiene un raddoppio della velocità. Se il raddoppio della concentrazione di un reagente provoca il raddoppio della velocità, allora quel reagente è del primo ordine. In questo caso, entrambi i reagenti sono del primo ordine. La somma di due reagenti del primo ordine è una reazione del secondo ordine.

2. Trova l`ordine di una reazione in cui il raddoppio di entrambi i reagenti non cambia la velocità. Se la modifica della concentrazione di un reagente non provoca un cambiamento nella sua velocità, quel reagente è di ordine zero. In questo caso, entrambi i reagenti sono di ordine zero. La somma di due ordini zero è un ordine di reazione generale di ordine zero.

3. Determinare l`ordine di una reazione in cui raddoppiando un reagente quadruplica la velocità. Il reagente che influenza la velocità di reazione è del secondo ordine. Il secondo reagente non influenza la velocità ed è di ordine zero. La somma degli ordini è due, quindi questa è una reazione di secondo ordine.
Articoli sull'argomento "Determinazione dell'ordine di una reazione"
Condividi sui social network:
Simile
Popolare