K Shell (interno): massimo 2 elettroni. L Shell: 8 elettroni massimo. M Shell: massimo 18 elettroni. N Shell: massimo 32 elettroni. O Shell: massimo 50 elettroni. P Shell (esterno): 72 elettroni massimo. 
Se il guscio di valenza è pieno, l`elemento è stabile. Se il guscio di valenza non è pieno, l`elemento è reattivo, il che significa che può formare un legame chimico con l`atomo di un altro elemento. Ogni atomo condivide i suoi elettroni di valenza nel tentativo di riempire il guscio di valenza. 

Idrogeno (H) ed Elio (He) hanno entrambi 1 guscio, mentre Francium (Fr) ne ha 7. I lantanidi e gli attinidi sono raggruppati ed elencati sotto la tabella principale. Tutti i lantanidi appartengono al periodo 6, gruppo 3 e tutti gli attinidi appartengono al periodo 7, gruppo 3. 
Gruppo 1: 1 elettrone di valenza Gruppo 2: 2 elettroni di valenza Gruppo 13: 3 elettroni di valenza Gruppo 14: 4 elettroni di valenza Gruppo 15: 5 elettroni di valenza Gruppo 16: 6 elettroni di valenza Gruppo 17: 7 elettroni di valenza Gruppo 18: 8 elettroni di valenza – eccetto l`elio, che ne ha 2 

Gruppo 3: 3 elettroni di valenza Gruppo 4: da 2 a 4 elettroni di valenza Gruppo 5: da 2 a 5 elettroni di valenza Gruppo 6: da 2 a 6 elettroni di valenza Gruppo 7: da 2 a 7 elettroni di valenza Gruppo 8: 2 o 3 elettroni di valenza Gruppo 9: 2 o 3 elettroni di valenza Gruppo 10: 2 o 3 elettroni di valenza Gruppo 11: 1 o 2 elettroni di valenza Gruppo 12: 2 elettroni di valenza
Determinazione del numero di elettroni di valenza
Contenuto
Gli elettroni di valenza si trovano nel guscio più esterno di un elemento. Il numero di elettroni di valenza in un atomo determina il tipo di legame chimico che questo elemento può formare. Il modo migliore per scoprire il numero di elettroni di valenza è utilizzare la tavola periodica degli elementi.
Passi
Metodo 1 di 3: Parte prima: Comprensione dei gusci di elettroni

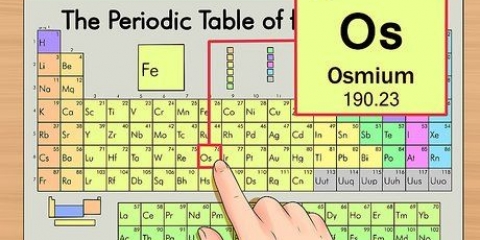
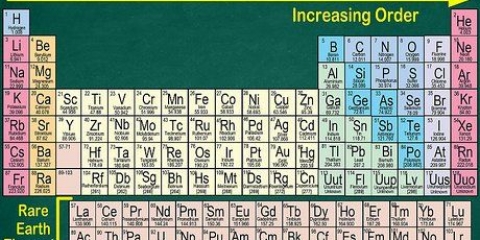
1. La tavola periodica degli elementi. Questa è una tabella di codici colore, in cui ogni cella mostra un elemento con il suo numero atomico e da 1 a 3 lettere come simbolo.

2. Trova il numero atomico dell`elemento. Il numero atomico è sopra o accanto al simbolo dell`elemento. Ad esempio: il boro (B) ha numero atomico 5, il che significa che ha 5 protoni e 5 elettroni.

3. Disegna una semplice rappresentazione di un atomo e posiziona gli elettroni in orbita attorno al nucleo. Queste orbite sono anche chiamate conchiglie o livelli di energia. Il numero massimo di elettroni che possono trovarsi nello stesso guscio è fisso e i gusci vengono riempiti dall`orbita più interna a quella più esterna.

4. Trova il numero di elettroni nel guscio esterno. Questi sono gli elettroni di valenza.
Metodo 2 di 3: Parte seconda: Trovare gli elettroni di valenza nei metalli eccetto i metalli di transizione

1. Numera ogni colonna della tavola periodica, da 1 a 18. L`idrogeno (H) è in cima alla colonna 1 e l`elio (He) è in cima alla colonna 18. Questi sono i diversi gruppi di elementi.

2. Numera ogni riga, da 1 a 7. Questi sono i periodi degli elementi e corrispondono al numero di gusci o livelli di energia di un atomo.

3. Individua un elemento che non sia un metallo di transizione. I metalli di transizione sono nei gruppi da 3 a 12. I numeri di gruppo degli altri metalli indicano il numero di elettroni di valenza.
Metodo 3 di 3: Parte terza: Trovare gli elettroni di valenza nei metalli di transizione

1. Trova un elemento dai gruppi da 3 a 12, i metalli di transizione.

2. Determina il numero di elettroni di valenza in base al numero del gruppo. Questi numeri di gruppo corrispondono a un possibile numero di elettroni di valenza.
Consigli
- I metalli di transizione possono avere gusci di valenza non completamente pieni. Determinare il numero esatto di elettroni di valenza nei metalli di transizione richiede alcuni principi della teoria quantistica che esulano dallo scopo di questo articolo.
Necessità
- Tavola periodica degli elementi
- Matita
- Carta
Articoli sull'argomento "Determinazione del numero di elettroni di valenza"
Condividi sui social network:
Simile
Popolare