In questo esempio, una molecola di ossigeno contiene ( ) due atomi di ossigeno.
) due atomi di ossigeno. La massa molare di un atomo di ossigeno è di circa 16 g/mol. Se necessario, puoi calcolare valori più precisi. 2 atomi di ossigeno x 16 g/mol per atomo = 32 g/mol  .
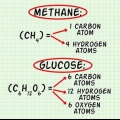
. L`altro reagente, il glucosio ( ) ha una massa molare di (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) ha una massa molare di (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol. Se vuoi vedere questo passaggio in modo più dettagliato, leggi Calcolo della massa molare. 
Ad esempio, supponiamo di iniziare con 40 grammi di ossigeno e 25 grammi di glucosio. 40 g  / (32 g/mol) = 1,25 mol di ossigeno.
/ (32 g/mol) = 1,25 mol di ossigeno. 25 g  / (180 g/mol) = circa 0,139 mol di glucosio.
/ (180 g/mol) = circa 0,139 mol di glucosio. 
Nell`esempio seguente, inizi con 1,25 moli di ossigeno e 0,139 moli di glucosio. Quindi il rapporto tra le molecole di ossigeno e glucosio è 1,25/0,139 = 9,0. Questo rapporto significa che hai nove volte più molecole di ossigeno del glucosio. 
Per questa reazione, i reagenti sono dati come  . I coefficienti indicano che sono necessarie sei molecole di ossigeno per ogni molecola di glucosio. Il rapporto ideale per questa reazione è 6 ossigeno / 1 glucosio = 6,0.
. I coefficienti indicano che sono necessarie sei molecole di ossigeno per ogni molecola di glucosio. Il rapporto ideale per questa reazione è 6 ossigeno / 1 glucosio = 6,0. 
Nell`esempio seguente, inizi con nove volte più ossigeno del glucosio, misurato dal numero di moli. La formula ti dice che il tuo rapporto ideale è sei volte più ossigeno al glucosio. Quindi hai bisogno di più ossigeno che glucosio. Quindi l`altro reagente, in questo caso il glucosio, è il reagente limitante. 

Nell`esempio sopra, il glucosio è il reagente limitante. Secondo i calcoli della massa molare, i primi 25 g di glucosio equivalgono a 0,139 mol di glucosio. 
La reazione di equilibrio per questo esempio è  →
→  . Questa equazione ti dice che puoi aspettarti sei molecole del prodotto desiderato, l`anidride carbonica (
. Questa equazione ti dice che puoi aspettarti sei molecole del prodotto desiderato, l`anidride carbonica ( ), e una molecola di glucosio (
), e una molecola di glucosio ( ).
). Il rapporto tra anidride carbonica e glucosio è 6/1 = 6. In altre parole, questa reazione può produrre sei molecole di anidride carbonica da una molecola di glucosio. 
In questo esempio, i 25 g di glucosio sono pari a 0,139 moli di glucosio. Il rapporto tra anidride carbonica e glucosio è 6:1. Ti aspetti di essere in grado di produrre sei volte più moli di anidride carbonica delle moli di glucosio con cui hai iniziato. La resa teorica di anidride carbonica è (0,139 mol di glucosio) x (6 mol di anidride carbonica/mol di glucosio) = 0,834 mol di anidride carbonica. 
Nell`esempio seguente, la massa molare di CO è2 circa 44 g/mol. (La massa molare del carbonio è ~12 g/mol e dell`ossigeno ~16 g/mol, quindi il totale è 12 + 16 + 16 = 44). Moltiplicare 0,834 mol CO2 x 44 g/mol CO2 = ~36,7 grammi. La resa teorica dell`esperimento è di 36,7 grammi di CO2. 
In questo esempio, l`acqua è il secondo prodotto  . Secondo la reazione di equilibrio, puoi aspettarti sei molecole d`acqua da una molecola di glucosio. Questo è un rapporto di 6:1. Quindi 0,139 moli di glucosio dovrebbero produrre 0,834 moli di acqua.
. Secondo la reazione di equilibrio, puoi aspettarti sei molecole d`acqua da una molecola di glucosio. Questo è un rapporto di 6:1. Quindi 0,139 moli di glucosio dovrebbero produrre 0,834 moli di acqua. Moltiplica le moli d`acqua per la massa molare dell`acqua. La massa molare è 2 + 16 = 18 g/mol. Moltiplicato per il prodotto si ottengono 0,139 mol H2O x 18 g/mol H2O = ~2,50 grammi. La resa teorica di acqua in questo esperimento è di 2,50 grammi.
Calcolo del rendimento teorico
Contenuto
La resa teorica è un termine usato in chimica per indicare la quantità massima di una sostanza ottenuta che ci si aspetta da una reazione chimica. Si inizia bilanciando un`equazione di reazione e definendo il reagente limitante. Quando si misura la quantità di reagente che si desidera utilizzare, è possibile calcolare la quantità di una sostanza ottenuta. Questa è la resa teorica dell`equazione. In un esperimento reale probabilmente ne perderai parte perché non è un esperimento ideale.
Passi
Parte 1 di 2: Determinazione del reagente limitante

1. Inizia con una reazione di equilibrio. Un`equazione di reazione assomiglia a una ricetta. Mostra quali reagenti (a sinistra) reagiscono tra loro per produrre prodotti (a destra). Una reazione di equilibrio avrà lo stesso numero di atomi sul lato sinistro dell`equazione (come reagenti) e sul lato destro (sotto forma di prodotti).
- Ad esempio, supponiamo di avere l`equazione semplice
→
. Ci sono due atomi di idrogeno a sinistra e a destra. Ma ci sono due atomi di ossigeno come reagente a sinistra e solo un atomo come prodotto a destra.
- Per bilanciare l`equazione, raddoppiamo il prodotto e otteniamo
→
.
- Controlla il saldo. Questo cambiamento ha fatto battere l`ossigeno, perché ora ha due atomi su entrambi i lati. Ma ora hai due atomi di idrogeno a sinistra con quattro atomi di idrogeno a destra.
- Raddoppia l`idrogeno nel reagente. Questo fa l`equazione
→
. Questo cambiamento ha ora portato a quattro atomi di idrogeno e due atomi di ossigeno su entrambi i lati. L`equazione è in equilibrio.
- Un esempio più complicato: ossigeno e glucosio possono reagire per formare anidride carbonica e acqua:
→
In questa equazione, ogni lato ha esattamente 6 atomi di carbonio (C), 12 atomi di idrogeno (H) e 18 atomi di ossigeno (O). L`equazione è in equilibrio. - Leggi questo articolo se vuoi controllare più a fondo le equazioni di reazione.

2. Calcola la massa molare di ciascuna reazione. Usando la tavola periodica o un altro libro di riferimento, trova la massa molare di ciascun atomo in ciascun composto. Aggiungili insieme per trovare la massa molare di ciascun composto di reagenti. Fallo per una singola molecola della composizione. Dai un`altra occhiata all`equazione della conversione di ossigeno e glucosio in anidride carbonica e acqua:  →
→ 
 →
→ 
 ) due atomi di ossigeno.
) due atomi di ossigeno. .
. ) ha una massa molare di (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) ha una massa molare di (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
3. Convertire la quantità di ciascun reagente da grammi a mol. Per un esperimento reale, sarà nota la massa in grammi di ciascun reagente utilizzato. Dividi questo valore per la massa molare di quella sostanza come conversione al numero di mol.
 / (32 g/mol) = 1,25 mol di ossigeno.
/ (32 g/mol) = 1,25 mol di ossigeno. / (180 g/mol) = circa 0,139 mol di glucosio.
/ (180 g/mol) = circa 0,139 mol di glucosio.
4. Determinare il rapporto molare dei reagenti. Una talpa è uno strumento di calcolo utilizzato in chimica per contare le molecole in base alla loro massa. Determinando le moli di ossigeno e glucosio, sai con quante molecole inizi. Per trovare il rapporto tra i due, dividi le moli di un reagente per quelle dell`altro.

5. Determinare il rapporto ideale per la reazione. Osserva la reazione di equilibrio. I coefficienti per ciascuna molecola indicano il rapporto tra le molecole necessarie affinché avvenga la reazione. Se usi esattamente il rapporto dato dalla formula, allora entrambi i reagenti dovrebbero essere usati allo stesso modo.
 . I coefficienti indicano che sono necessarie sei molecole di ossigeno per ogni molecola di glucosio. Il rapporto ideale per questa reazione è 6 ossigeno / 1 glucosio = 6,0.
. I coefficienti indicano che sono necessarie sei molecole di ossigeno per ogni molecola di glucosio. Il rapporto ideale per questa reazione è 6 ossigeno / 1 glucosio = 6,0.
6. Confronta i rapporti per trovare il reagente limitante. Nella maggior parte delle reazioni chimiche, uno dei reagenti si esaurirà prima dell`altro. Il reagente che viene consumato per primo è chiamato reagente limitante. Questo reagente limitante determina per quanto tempo può continuare la reazione chimica e la resa teorica che ci si può aspettare. Confronta i due rapporti calcolati per determinare il reagente limitante:
Parte 2 di 2: Determinazione della resa teorica

1. Visualizza il commento per trovare il prodotto desiderato. Il lato destro di un`equazione chimica mostra i prodotti prodotti dalla reazione. Se la reazione è bilanciata, i coefficienti di ciascun prodotto indicano quanti di ciascun rapporto molecolare aspettarsi. Ogni prodotto ha un rendimento teorico, ovvero la quantità di prodotto che ti aspetteresti quando la reazione è completamente completa.
- Continuando l`esempio sopra, si analizza la reazione
→
. I due prodotti a destra sono anidride carbonica e acqua.
- Puoi iniziare con entrambi i prodotti se vuoi calcolare la resa teorica. In alcuni casi è possibile che tu sia interessato solo a uno dei due prodotti. Se è così, è quello con cui inizierai.

2. Annota le moli del tuo reagente limitante. Dovresti sempre confrontare il numero di moli di reagente limitante con il numero di moli di un prodotto. Se provi a confrontare la massa di ciascuno, non otterrai il risultato corretto.

3. Confronta il rapporto tra le molecole nel prodotto e il reagente. Ritorna alla reazione di equilibrio. Dividi il numero di molecole del prodotto desiderato per il numero di molecole del reagente limitante.
 →
→  . Questa equazione ti dice che puoi aspettarti sei molecole del prodotto desiderato, l`anidride carbonica (
. Questa equazione ti dice che puoi aspettarti sei molecole del prodotto desiderato, l`anidride carbonica ( ), e una molecola di glucosio (
), e una molecola di glucosio ( ).
).
4. Moltiplicare questo rapporto per il numero di moli del reagente limitante. La risposta è la resa teorica, in moli, del prodotto desiderato.

5. Converti il risultato in grammi. Questo è l`inverso del passaggio precedente per calcolare il numero di moli o la quantità di reagente. Se conosci il numero di moli da aspettarsi, moltiplicalo per la massa molare del prodotto per determinare la resa teorica in grammi.

6. Ripetere il calcolo per l`altro prodotto, se lo si desidera. In molti esperimenti potresti essere interessato solo all`efficienza di un determinato prodotto. Se vuoi conoscere la resa teorica di entrambi i prodotti non ti resta che ripetere il procedimento.
 . Secondo la reazione di equilibrio, puoi aspettarti sei molecole d`acqua da una molecola di glucosio. Questo è un rapporto di 6:1. Quindi 0,139 moli di glucosio dovrebbero produrre 0,834 moli di acqua.
. Secondo la reazione di equilibrio, puoi aspettarti sei molecole d`acqua da una molecola di glucosio. Questo è un rapporto di 6:1. Quindi 0,139 moli di glucosio dovrebbero produrre 0,834 moli di acqua.Articoli sull'argomento "Calcolo del rendimento teorico"
Condividi sui social network:
Simile
Popolare