Esempio di assegnazione: Mol = 0,75 moli NaCl Volume = 4,2 l 
Esempio di problema: molarità = 0,75 mol / 4.2L = 0,17857142 
Esempio di assegnazione: 0,179 M NaCl 

Esempio di assegnazione: Massa = 3,4 g KMnO4 Volume = 5,2 l 
Esempio di assegnazione: La massa molare di K = 39,1 g La massa molare di Mn = 54,9 g La massa molare di O = 16,0 g Massa molare totale = K + Mn + O + O + O + O = 39,1 + 54.9 + 16 + 16 + 16 + 16 = 158,0 grammi 
Esempio di problema: grammi di sostanza * (1/massa molare della sostanza) = 3,4 g * (1 mol / 158 g) = 0,0215 mol 
Esempio di problema: molarità = 0,0215 mol / 5.2L = 0.004134615 
Esempio di assegnazione: 0,004 M KMnO4 

Esempio di assegnazione: Numero di moli = 1,2 moli CaCl2 Volume = 2905 ml 
Esempio di dichiarazione: 2905 ml * (1 L / 1000 ml) = 2905 L 
Esempio di assegnazione: 1,2 mol di CaCl2 / 2905L = 0,413080895 
Esempio di assegnazione: 0,413 M CaCl2 

La massa molare di Na = 22,99 g La massa molare di Cl = 35,45 g La massa molare di NaCl = 22,99 + 35.45 = 58,44 grammi 
Mole NaCl = 5,2 g NaCl * (1 mol / 58,44 g) = 0,08898 mol = 0,09 mol 
Puoi anche vederlo moltiplicando 800 ml per un fattore di conversione di 1 L / 1000 ml. Per farlo rapidamente, tutto ciò che devi fare è spostare la virgola decimale di 3 cifre a sinistra, invece di calcolarla. Volume = 800 ml * (1 L / 1000 ml) = 800 ml / 1000 ml = 0,8 L 
Molarità = numero di moli di sostanza / numero di litri di soluzione = 0,09 mol / 0,8 L = 0,1125 mol/L 
Risposta: 0,11 M NaCl
Calcolo della molarità di una soluzione
Contenuto
La molarità è una descrizione della relazione tra il numero di moli di un liquido e il suo volume. Per calcolare la molarità si inizia con moli e volume, massa e volume o moli e millilitri. Queste variabili vengono quindi inserite nella formula standard di calcolo della molarità per (si spera) ottenere la risposta corretta.
Passi
Metodo 1 di 4: calcolo della molarità utilizzando moli e volume

1. Impara la formula standard per il calcolo della molarità. La molarità è uguale al numero di moli di un soluto diviso per il volume della soluzione in litri. Questo è già scritto: molarità = numero di moli di sostanza / numero di litri di soluzione
- Esempio di assegnazione: qual è la molarità di una soluzione di 0,75 mol di NaCl in 4,2 litri di acqua?

2. Visualizza il compito. Il calcolo della molarità richiede un certo numero di moli di sostanza e un certo numero di litri di soluzione. Se la dichiarazione prevede queste cifre, non è necessario svolgere alcun lavoro preparatorio.

3. Dividi il numero di moli per il numero di litri. La frazione che ottieni fornisce quindi il numero di moli per litro di soluzione, noto anche come molarità.

4. Scrivi la tua risposta. Completa la risposta correttamente, in base ai tuoi dati di misurazione e ai requisiti del problema. Breve la parola "molarità" via con "m" e usa il nome chimico del soluto.
Metodo 2 di 4: Calcolo della molarità con massa e volume

1. Conosci la formula standard per il calcolo della molarità.molarità = numero di moli di sostanza / numero di litri di soluzione
- Esempio di problema: qual è la molarità di una soluzione sciogliendo 3,4 g di KMnO4 in 5,2 litri o acqua?

2. Visualizza il compito. Il calcolo della molarità richiede un certo numero di moli di sostanza e un certo numero di litri di soluzione. Se la dichiarazione non fornisce queste cifre, è necessario eseguire alcuni lavori preliminari prima di poter continuare.

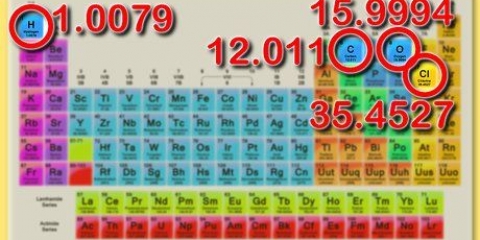
3. Determina la massa molare del soluto. Per trovare le moli del soluto bisogna prima calcolare la massa molare. Lo fai sommando le diverse masse molari di ciascun elemento della sostanza. Questa massa molare può essere trovata usando la tavola periodica.

4. Converti grammi in moli. Ora che conosci la massa molare del soluto, è ancora necessario convertirla nel numero di mol. Lo fai determinando quanto pesa 1 mole della sostanza e quindi moltiplicandolo per la massa molare.

5. Dividi il numero di moli per il numero di litri di soluzione per trovare la molarità.

6. Scrivi la tua risposta. Completa la risposta correttamente, in base ai tuoi dati di misurazione e ai requisiti del problema. Breve la parola "molarità" via con "m" e usa il nome chimico del soluto.
Metodo 3 di 4: calcolo della molarità utilizzando moli e millilitri

1. Conosci la formula standard per il calcolo della molarità.molarità = numero di moli di sostanza / numero di litri di soluzione. Se il volume è espresso in millilitri, dovrai convertirlo.
- Esempio di problema: qual è la molarità di una soluzione di 1,2 mol di CaCl2 in 2905 millilitri di acqua?

2. Visualizza il compito. Il calcolo della molarità richiede un certo numero di moli di sostanza e un certo numero di litri di soluzione. Se la dichiarazione non fornisce queste cifre, è necessario eseguire alcuni lavori preliminari prima di poter continuare.

3. Converti il numero di millilitri in litri. Trova il numero di litri della soluzione dividendo il volume per 1000 o spostando la virgola decimale di 3 cifre a sinistra.

4. Dividi il numero di moli per il numero di litri. Ora che hai tutti i numeri in fila puoi calcolare la molarità della soluzione.

5. Scrivi la tua risposta. Completa la risposta correttamente, in base ai tuoi dati di misurazione e ai requisiti del problema. Breve la parola "molarità" via con "m" e usa il nome chimico del soluto.
Metodo 4 di 4: problema di pratica extra

1. Vogliamo determinare la molarità di una soluzione di 5,2 g di NaCl in 800 ml di acqua. Per prima cosa elenca questi valori per chiarezza: massa in grammi e volume in millilitri.
- Massa = 5,2 g NaCl
- Volume = 800 ml di acqua

2. Determinare la massa molare di NaCl. Lo fai aggiungendo la massa molare di sodio (Na) e la massa molare di cloro (Cl).

3. Moltiplicare la massa della sostanza per il fattore di conversione della massa molare. In questo esempio, la massa molare di NaCl è 58.44 g, quindi hai 1 mole / 58,44 g.

4. Dividere 800 ml di acqua per 1000 per ottenere il numero di litri.

5. Dividi le moli di una sostanza per i litri della soluzione. Per trovare la molarità, dividere 0,09 mol della sostanza NaCl per 0,8 L della soluzione.

6. Rendi la tua risposta più ordinata. Arrotonda la tua risposta a due o tre cifre decimali e abbrevia la molarità a "M."
Articoli sull'argomento "Calcolo della molarità di una soluzione"
Condividi sui social network:
Simile
Popolare