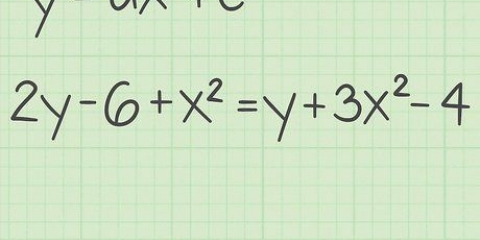Ad esempio: esafluoruro di azoto. Il primo elemento è l`azoto e il simbolo chimico dell`azoto è N. 
Ad esempio: Dinitrogen ha il prefisso `di-` che significa 2; Quindi sono presenti due atomi di azoto. Scrivi diazoto come N2. 
Ad esempio: esafluoruro di diazoto. Il secondo elemento è il fluoro. Ometti semplicemente il finale `-ide` per ottenere il nome effettivo dell`elemento. Il simbolo chimico del fluoro è F. 
Ad esempio: l`esafluoruro ha il prefisso `hexa-` che significa 6; Ecco perché sono presenti 6 atomi di fluoro. Scrivi esafluoruro come F6. La formula chimica finale per l`esafluoruro di diazoto è N2F6. 
Anidride solforosa: SO2 Tetrabromuro di carbonio: Cbr4 Anidride difosforo: P2o5 

Ci sono solo 3 cationi poliatomici e questi sono ammonio (NH4), idronio (H3) e mercurio (I) (Hg2 Il resto degli ioni poliatomici ha cariche negative comprese tra -1 e -4. Alcuni esempi comuni sono il carbonato (CO3), solfato (SO4), nitrato (N3) e cromato (CrO4). 
Tutti gli elementi del gruppo 1 sono 1+. Tutti gli elementi del gruppo 2 sono 2+. Gli elementi di transizione hanno numeri romani per indicare la loro carica. L`argento è 1+ Lo zinco è 2+ e l`alluminio è 3+. Il gruppo 17 è 1-. Il gruppo 16 è 2-. Il gruppo 15 è 3-. Ricorda che quando hai a che fare con ioni poliatomici puoi semplicemente sfruttare la carica dello ione. 
Ad esempio: ossido di litio. Il litio è un elemento del gruppo 1 e ha una carica di 1+. L`ossigeno è un elemento del gruppo 16 e ha una carica di 2-. Per bilanciare la carica 2- di ossigeno, sono necessari 2 atomi di litio; Pertanto, la formula chimica dell`ossido di litio è Li2o. 
Nitruro di calcio: il simbolo del calcio è Ca e il simbolo dell`azoto è N. Ca è un elemento del gruppo 2 e ha carica 2+. L`azoto è un elemento del gruppo 15 e ha una carica di 3-. Per bilanciare questo, hai bisogno di 3 atomi di calcio (6 +) e 2 atomi di azoto (6-): Ca3n2. Mercurio (II) Fosfato: il simbolo di Mercurio è Hg e il fosfato è lo ione poliatomico PO PO4. Mercurio ha una carica di 2+ come indicato accanto ad esso dal numero romano II. Il fosfato ha una carica di 3-. Per bilanciarli sono necessari 3 atomi di mercurio (6+) e 2 molecole di fosfato (6-): Hg3(PO4)2. 

Ricordarsi di bilanciare le cariche quando si formano nuovi composti. Ad esempio: AgNO3 + NaCl --> ? Ag è ora accoppiato a Cl per formare AgCl. Na è ora collegato a NO3 a NaNO3 dare forma. 
Ad esempio: AgNO3 + NaCl --> ? AgNO3 + NaCl --> AgCl + NaNO3 
Ad esempio: AgNO3 + NaCl --> AgCl + NaNO3 Conta il numero di atomi su entrambi i lati: 1 Ag a sinistra, 1 Ag a destra; 1 N a sinistra, 1 N a destra; 3 O a sinistra, 3 O a destra; 1 Dopo a sinistra, 1 Dopo a destra; 1 Cl a sinistra, 1 Cl a destra. Questa equazione di reazione è in equilibrio perché c`è lo stesso numero di atomi su entrambi i lati sinistro e destro dell`equazione. 
NiCl2 + (NH4)2S --> ? Cationi: Ni e NH4 Anioni: Cl e S Riorganizzare gli ioni per creare nuovi prodotti: NiS + NH4cl Scrivi l`equazione: NiCl2 + (NH4)2S --> NiS + NH4cl Bilancia l`equazione: NiCl2 + (NH4)2S --> NiS + 2NH4cl
Fare un'equazione chimica
Contenuto
Un buon modo per pensare a una reazione chimica è il processo di cottura dei biscotti. Mescoli gli ingredienti (farina, burro, sale, zucchero e uova), cuoci la pastella e la vedi trasformarsi in qualcosa di nuovo. Biscotti. In termini chimici la ricetta è l`equazione, gli ingredienti sono i `reagenti` e i biscotti sono i `prodotti`. Tutte le equazioni di reazione assomigliano a `A + B --> C (+ D..)`, dove ogni lettera maiuscola è un elemento o una molecola (un insieme di atomi tenuti insieme da legami chimici). La freccia indica la reazione o il cambiamento in atto. Per scrivere le equazioni ci sono alcune importanti regole di denominazione che dovrai conoscere.
Passi
Parte 1 di 3: Scrittura di formule chimiche di legami covalenti

1. Impara i prefissi per il numero di atomi. Quando si nominano i composti, i prefissi greci vengono utilizzati per indicare il numero di atomi presenti in ciascun elemento. I legami covalenti hanno il primo elemento scritto per intero, mentre al secondo elemento è assegnato un suffisso `-ide`. Ad esempio, il trisolfuro di pentaossido di difosforo ha la formula chimica P2S3. Questi sono i prefissi per 1-10:
- 1: Mono-
- 2: Di-
- 3: Tri-
- 4: tetra-
- 5: Penta-
- 6: esadecimale-
- 7: Epta-
- 8: Ott-
- 9: Nona-
- 10: Dec-

2. Annota il simbolo chimico del primo elemento. Quando un composto viene scritto, è necessario indicare gli elementi e conoscerne i simboli chimici. Il primo elemento che viene annotato è il `nome` della composizione. Usa la tavola periodica per trovare il simbolo chimico di un elemento.

3. Aggiungi il numero di atomi come pedice. Per identificare il numero di atomi presenti per ogni elemento, tutto ciò che devi fare è guardare il prefisso dell`elemento. La memorizzazione dei prefissi greci ti aiuterà a scrivere rapidamente le formule chimiche, senza dover cercare nulla.

4. Annota il simbolo chimico del secondo elemento. Il secondo elemento è il «cognome» della sostanza e segue il primo elemento. Nei legami covalenti, i nomi degli elementi hanno il suffisso `-ide` invece della normale terminazione dell`elemento.

5. Aggiungi in pedice il numero di atomi presenti. Come per il primo elemento, si determina il numero di atomi nel secondo elemento leggendo il prefisso. Con questo prefisso scrivi il numero di atomi come pedice a destra del simbolo chimico.

6. Esercitati con alcuni esempi. Se hai appena iniziato con la chimica, c`è molto da memorizzare. È come imparare una nuova lingua. Più ti eserciti con i problemi dei campioni, più facile sarà decifrare le formule chimiche in futuro e imparare il linguaggio della chimica.
Parte 2 di 3: Scrivere formule chimiche di legami ionici

1. Determina i simboli chimici per i cationi e gli anioni. Tutte le sostanze chimiche hanno un nome e un cognome. Il nome è il catione (ione positivo) mentre il cognome è l`anione (ione negativo). I cationi sono scritti come nome dell`elemento mentre gli anioni sono il nome dell`elemento che termina con il suffisso `-ide`.
- Il simbolo chimico di ogni elemento si trova sulla tavola periodica.
- A differenza dei legami covalenti, i prefissi greci non vengono utilizzati per indicare il numero di atomi di ciascun elemento. Devi bilanciare le cariche degli elementi, per determinare il numero di atomi.
- Ad esempio: l`ossido di litio è Li2o.

2. Riconosci gli ioni poliatomici. A volte il catione o anione è uno ione poliatomico. Queste sono molecole che contengono due o più atomi con gruppi ionici. Non c`è nessun trucco per ricordarlo, dovrai solo memorizzarli.

3. Determina la valenza di ogni elemento. La valenza può essere determinata osservando la posizione dell`elemento nella tavola periodica. Ci sono alcune regole da tenere a mente che possono aiutarti a determinare i carichi:

4. Bilancia le cariche positive e negative degli ioni. Una volta determinata la carica di ciascun elemento (o ione poliatomico), utilizzerai queste cariche per determinare il numero di atomi presenti in ciascun elemento. L`intento è quello di impostare la carica del composto a zero, quindi aggiungerai atomi per bilanciare le cariche.

5. Esercitati con alcuni esempi. Il modo migliore per imparare a scrivere formule è esercitarsi con molti esempi. Usa esempi nel tuo libro di testo di chimica o cerca online esercizi pratici. Fai il più possibile finché non impari a scrivere formule chimiche.
Parte 3 di 3: Determina i prodotti di determinati reagenti

1. Determina tutti i cationi e gli anioni nei reagenti. Nell`equazione di una semplice doppia equazione di sostituzione, ci sono due cationi e anioni. L`equazione generale è nella forma di AB + CD --> AD + CB, dove A e C sono cationi e B e D sono anioni. Determina anche la carica di ogni ione.
- Ad esempio: AgNO3 + NaCl --> ?
- I cationi sono: Ag. Gli anioni sono: NO3 e Cl.

2. Scambia gli ioni per creare i prodotti. Una volta determinati tutti gli ioni e le loro cariche, disponili in modo che il primo catione sia legato al secondo anione e il secondo catione sia legato al primo anione. Ricorda l`equazione: AB + CD --> dC + BC.

3. Scrivi l`equazione completa. Dopo aver scritto i prodotti che si formano nell`equazione, puoi scrivere l`intera equazione sia con i prodotti che con i reagenti. Metti i reagenti sul lato sinistro dell`equazione e scrivi i nuovi prodotti sul lato destro, con un segno più in mezzo.

4. Porta l`equazionein equilibrio. Una volta che hai scritto l`equazione e determinato tutti i prodotti e reagenti, assicurati che tutto sia in equilibrio. Un`equazione è in equilibrio solo quando ci sono lo stesso numero di atomi di ciascun elemento su entrambi i lati.

5. Esercitati con alcuni esempi. L`unico modo per migliorare nella scrittura delle equazioni è esercitarsi effettivamente. Esamina i seguenti esempi per assicurarti di comprendere veramente il processo.
Articoli sull'argomento "Fare un'equazione chimica"
Condividi sui social network:
Popolare