Li2S = solfuro di litio
Ag2S = solfuro d`argento
MgCl2 = Cloruro di magnesio












Nominare i legami ionici
Contenuto
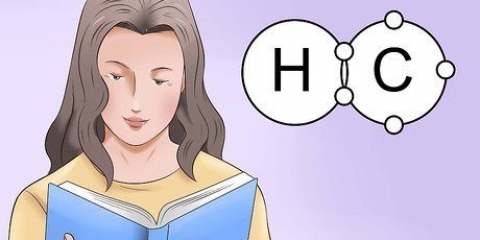
I legami ionici sono costituiti da cationi (ioni positivi) e anioni (ioni negativi). I legami ionici di solito sono costituiti da un metallo e uno o più non metalli. Per nominare un legame ionico, devi solo trovare il nome del catione e dell`anione presenti nel composto. Devi prima scrivere il nome del metallo, seguito dal nome del non metallo con la sua nuova fine corrispondente. Se vuoi sapere come nominare i legami ionici in diverse situazioni, segui questi passaggi.
Passi
Metodo 1 di 3: legami ionici basici

1. Scrivi la formula del legame ionico. Diciamo il legame ionico su cui stai lavorando NaCl è.

2. Annota il nome del metallo, o catione. Questo è lo ione caricato positivamente nel legame ed è sempre scritto per primo nella formula di un legame ionico. A seguito di è sodio. Quindi scrivi Sodio in poi.

3. Scrivi il nome del non metallo, o anione, con il "-idea" Uscita.cl è cloro (cloro). Attorno a "idea" per aggiungere la fine, hai solo bisogno dell`ultima sillaba "-ine" essere sostituito da "-idea". Il cloro diventa cloruro.

4. Combina i nomi. NaCl può essere scritto come cloruro di sodio.

5. Esercitati a nominare semplici legami ionici. Una volta che hai successo in questa formula, prova a nominare alcuni legami ionici più semplici. Memorizzare anche solo alcuni può aiutarti a capire meglio come nominare i legami ionici. Eccone altri:



Metodo 2 di 3: metalli di transizione

1. Scrivi la formula del legame ionico. I metalli di transizione si trovano al centro della tavola periodica. Hanno preso il loro nome perché i loro numeri di ossidazione, o le loro cariche, cambiano costantemente. Diciamo che stai lavorando con questo legame: Fe2o3.

2. Annota la carica del metallo. Sai che il metallo avrà una carica positiva, quindi puoi usare il 3 di o3 cancellalo e scrivilo Fe ha una carica di +3. (Puoi, per divertimento, fare il contrario e scriverlo o ha una carica di -2.) A volte l`addebito verrà dichiarato.

3. Scrivi il nome del metallo. Dal momento che lo sai Fe ferro e che ha una carica di +3, puoi Ferro(III) menzionare. Ricorda di usare solo numeri romani quando scrivi il nome e non quando scrivi la formula.

4. Annota il nome del non metallo. Dal momento che lo sai o sta per ossigeno, puoi usare il "-idea" aggiungi output e questo "ossido" menzionare.

5. Unisci il nome e il secondo nome. Ora ce l`hai. Fe2o3 = Ossido di ferro (III).

6. Usa il vecchio metodo di denominazione. Utilizzi il vecchio metodo di denominazione, che viene anche utilizzato, il "ferroso" e "ferrico" nomi dei metalli, al posto dei numeri romani. Se lo ione metallico ha uno stato di ossidazione inferiore (una carica numerica inferiore, dove si "+" o "-" ignora), si utilizza "ferroso". Se ha una carica più alta, usa "ferrico". Fe ha lo stato inferiore (Fe ha lo stato superiore), quindi diventa ferroso. Il nome di FeO può anche essere scritto come ossido ferrico.

7. Ricorda le eccezioni. Ci sono due metalli di transizione che non hanno carica fissa. Questi sono zinco (Zn) e argento (Ag). Ciò significa che non è necessario utilizzare i numeri romani o il vecchio metodo di denominazione per descrivere quegli elementi.
Metodo 3 di 3: legami con ioni poliatomici

1. Scrivi la formula dello ione poliatomico. Questo legame sarà composto da più di due ioni. Diciamo che stai lavorando sul seguente legame: FeNH4(COSÌ4)2.

2. Trova la carica del metallo. Dovrai fare un po` di matematica per trovarlo. Prima di tutto sai che il solfato, o SO4 ione, ha una carica di -2 e che ce ne sono due, a causa del 2 sotto la parentesi. Quindi, 2 x -2 = -4. Allora sai che NH4, se lo ione ammoniaca ha una carica di +1. Somma -4 e 1 insieme e ottieni -3. Ciò significa che lo ione ferro, Fe, deve avere una carica di +3 per equalizzare e rendere neutro il legame.

3. Scrivi il nome del metallo. In questo caso puoi anche tu Ferro(III) Se ferrico annotare.

4. Annota il nome degli ioni non metallici. In questo caso usi ammonio e solfato, o solfato d`ammonio.

5. Combina il nome del metallo con i nomi dei non metalli. Puoi nominare il legame FeNH4(COSÌ4)2 passare entrambi solfato di ferro(III) ammonio o solfato di ammonio ferrico scrivere.
Consigli
- Se vai nella direzione opposta e hai numeri romani, devi fare una "radiografia" della molecola. Il numero romano è la carica del catione.
Articoli sull'argomento "Nominare i legami ionici"
Condividi sui social network:
Popolare